Por: Ignacio López-Goñi
(microbiun.blogspot)
El 10 de enero de 2020, hace exactamente un año, publiqué el que quizá haya sido el primer artículo en castellano sobre lo que entonces se denominada el coronavirus “chino” y ahora llamamos SARS-CoV-2. El 31 de diciembre de 2019 las autoridades chinas anuncian la existencia de unos pocos casos de una neumonía atípica de origen desconocido. El 10 de enero de 2020 se hizo público el genoma del virus causante de esa rara neumonía, un nuevo coronavirus. El 12 de enero las autoridades chinas notifican el primer fallecimiento. El número total de casos confirmados era de 41, en ese momento no había evidencia de transmisión entre humanos. Al día siguiente ya estaba en la web de la OMS el primer protocolo de RT-PCR para la detección del virus. El día 30 de ese mismo mes la OMS declara la emergencia sanitaria internacional. El resto de la historia ya la conocen.
COVID-19, la enfermedad que causa el virus SARS-CoV-2, ha sido la primera pandemia del siglo XXI. A día de hoy, son más de 89 millones de personas infectadas, la extensión es prácticamente planetaria y ha causado cerca de 2 millones de muertos. Ha sido un año muy duro, lo más parecido a una guerra que muchos hemos vivido. Pero ha sido el año de la ciencia. Si en 1980 se describieron los primeros casos de SIDA y se tardaron más de dos años solo en identificar el agente causante (el virus VIH), ahora en menos de doce meses hay 85 prototipos de vacunas en fases preclínicas y 64 en ensayos clínicos, 20 ya en fase III y al menos tres aprobadas para su uso. Solo la ciencia, el conocimiento y la cooperación nos sacará de esta pandemia. Repasemos en qué consisten algunas de las vacunas contra SARS-CoV-2.
(Autores: V. Asensio & I. López-Goñi, disponible en wikimedia).
Vacunas ARNm
En este momento las más avanzadas son la BNT162b2 (nombre genérico Tozinameran, nombre comercial Comirnaty) desarrollada por Pfizer/BioNTech, y la mRNA-1273 desarrollada por Moderna. En los ensayos clínicos en fase III ambas han demostrado una eficacia excelente y similar (95%, 94,1%, respectivamente). Una diferencia importante es que la de Pfizer/BioNTech requiere una temperatura de almacenamiento de -80ºC mientras que la de Moderna es de -20ºC.
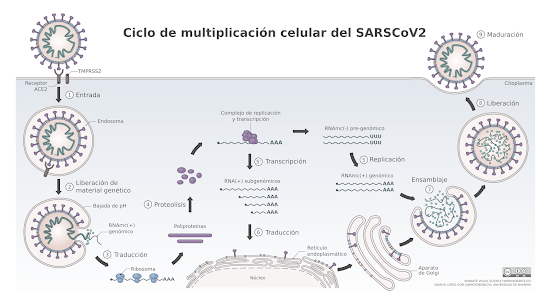
Se basan en el gen que codifica para la proteína S (la glicoproteína de la envoltura del virus que actúa como la llave que se une al receptor de la célula). Son una secuencia de ARN que se ha modificado para aumentar su estabilidad y facilitar que la célula sea capaz de “leerla” y traducirla como un ARNm y sintetizar la proteína viral. Para facilitar que esta molécula sea transportada al interior de las células, va encapsulada en una nanopartícula lipídica que se fusionará con la membrana de la célula. Algunos de los lípidos que forman estas nanopartículas son derivados del polietilenglicol, fosfolípidos, colesterol y otros. Se administra por vía intramuscular en dos dosis separadas 21-28 días.
Las nanopartículas lipídicas se fusionan con la membrana de las células musculares, y liberan las cadenas de ARNm en el citoplasma. Éstas son reconocidas por los ribosomas y por toda la maquinaria enzimática de la célula y sintetizan la proteína S del virus. Es como si a la célula le hubiéramos dado el libro de instrucciones (ARNm) para que ella misma sintetizará la proteína del virus. La vida media del ARNm de la vacuna es muy corta y la molécula se destruirá rápidamente. La proteína S así sintetizada migrará a la superficie de la célula de forma que las células vacunadas expondrán fragmentos de la proteína en su superficie, que serán reconocidos por el sistema inmune. Además, cuando esas células vacunadas se destruyan, los restos celulares que contendrán fragmentos de la proteína S activarán un tipo de células del sistema inmune denominadas células presentadoras de antígenos. Estás células serán las encargas de activar al resto de células inmunes, los linfocitos T que regulan la respuesta contra las células infectadas con el virus, y los linfocitos B que producirán los anticuerpos contra la proteína S.
Vacunas basadas en adenovirus
Las vacunas AZD1222 (también conocida como ChAdOx1) desarrollada por Oxford-AstraZeneca, la JNJ-78436735 (Ad26.COV2.S) desarrollada por Johnson & Johnson, y la rusa Sputnik V (Gam-Covid-Vac) se basan en vectores de adenovirus.
En este caso, el gen de la proteína S se integra en el genoma de otro virus, un adenovirus, que actúa como vector o vehículo para inyectar el gen en el núcleo de la célula vacunada. Los adenovirus son un tipo de virus que causan catarros comunes. Estas vacunas utilizan una versión modificada de los adenovirus que los hacen inofensivos, pueden entrar dentro de las células pero no son capaces de replicarse. La vacuna de Oxford-AstraZeneca emplea un adenovirus de chimpancé (lo de “ChAd” viene de Chimpanzee Adenovirus), la vacuna de Johnson & Johnson emplea un adenovirus humano denominado Adenovirus 26 (Ad26), y la rusa Sputnik V es la combinación de dos adenovirus humanos diferentes, el Ad26 y el adenovirus 5 (Ad5). Se ha sugerido que nuestro sistema inmune, que ya ha tenido contacto previo con otros adenovirus humanos, podría responder frente a este tipo de vacunas fabricando anticuerpos contra el adenovirus vector, lo que podría reducir la eficacia de las vacunas. Para evitar esto, la vacuna de Oxford-AstaZeneca ha optado por utilizar como vectores adenovirus de chimpancé en vez de humanos, mientras que la rusa Sputnik V emplea el Ad26 en la primera dosis vacunal y el Ad5 en la segunda.
Este tipo de vacunas han sido ensayadas anteriormente contra otros virus como el ébola, HIV y zika. Además son más resistentes que las vacunas ARNm, el ADN no es tan frágil como el ARN y va rodeado de la cubierta proteica del adenovirus vector que lo protege. Por eso, no requieren temperaturas de congelación para su almacenaje y resisten hasta seis meses a temperaturas de refrigeración (2-8ºC).
Una vez inyectadas en el músculo, el adenovirus se adhiere a la superficie de la célula y entra en su interior en forma de una vesícula. Dentro de la célula, el adenovirus escapa de esa vesícula, viaja hasta la superficie de la membrana nuclear e inyecta su ADN en el núcleo de la célula. El adenovirus está modificado de forma que no puede multiplicarse, pero el gen de la proteína S del SARS-CoV-2 es reconocido por la maquinaria enzimática de la célula y se transcribe a ARNm. Este ARNm que lleva la información de la proteína S abandona el núcleo, es reconocido por los ribosomas y se sintetiza la proteína S. A partir de aquí, el mecanismo de activación del sistema inmune es similar al explicado para las vacunas ARNm. Sin embargo, una diferencia es que el propio adenovirus provoca una activación inespecífica del sistema inmune por lo que este tipo de vacunas suelen generan una respuesta inmune más potente frente a las proteínas S.
La vacuna de Oxford-AstraZeneca requiere dos dosis, separadas cuatro semanas. Los ensayos clínicos han demostrado una eficacia entre 62-90%, dependiendo de la dosis. En concreto, la combinación de dos dosis completas obtuvo una eficacia del 62%, pero, curiosamente, cuando en la primera dosis se administró la mitad, se obtuvo una eficacia mayor del 90%. Parece ser que una primera dosis menor se asemeja más a una infección real y promueve una respuesta inmune más potente cuando se administra la segunda dosis.
Los ensayos clínicos con la rusa Sputnik V han demostrado una eficacia del 91%. En este caso también se requiere dos dosis, la primera con el Ad26 y la segunda con el Ad5, como ya hemos comentado. En el caso de la vacuna de Johnson & Johnson, que emplea solo una dosis, se esperan los resultados de los ensayos clínicos en el mes de enero de 2021.
Vacunas de proteínas
La vacuna NVX-CoV2373 (de la empresa Novavax), está en fase III y todavía no ha sido autorizada en ningún país. Se trata de una vacuna de proteína S purificada. Para ello, han insertado el gen S en otro virus, un baculovirus. Son virus de insectos que infectan células de polillas y se emplean como vectores de expresión para producir grandes cantidades de proteínas. Las células infectadas por el baculovirus recombinante producen la proteína S, se purifica y se ensamblan en nanopartículas que imitan la estructura molecular de la superficie del coronavirus, que obviamente no se pueden replicar ni causar la COVID-19. La vacuna incluye un compuesto que actúa como adyuvante, para que la respuesta inmune sea más potente, y se administra intramuscularmente. Una ventaja importante es que es estable por al menos tres meses en el refrigerador.
Vacunas con virus inactivos
Las vacunas con virus inactivos, muertos, se han empleado desde hace décadas y son la base de vacunas tan exitosas como la de la polio (la vacuna de Salk), la rabia o la hepatitis A, entre otras. Emplean coronavirus inactivos las vacunas chinas BBIBP-CorV (de la compañía Sinopharm), CoronaVac (de la empresa Sinovac) y la india Covaxin (de la compañía Bharat Biotech).
Para la vacuna BBIBP-CorV, los investigadores obtuvieron tres variantes del coronavirus de pacientes de hospitales chinos. Seleccionaron la que era capaz de multiplicarse rápidamente en células de riñón de mono y de crecer a gran escala en bioreactores. Una vez que obtuvieron una gran cantidad de virus, los inactivaron con beta-propiolactona. Así, inactivados, los coronavirus no pueden replicarse, pero sus proteínas, incluida la proteína S, se mantienen intactas. En la vacuna se mezclan también con algunas sustancias adyuvantes para mejorar la respuesta inmune. De forma similar, para crear la vacuna CoronVac, se obtuvieron coronavirus de muestras de pacientes de China, Inglaterra, Italia, España y Suiza. Una de las muestras de China fue la que finalmente se empleó como base para esta vacuna. De momento solo hay datos de la eficacia en fase III de esta última, un 78%.
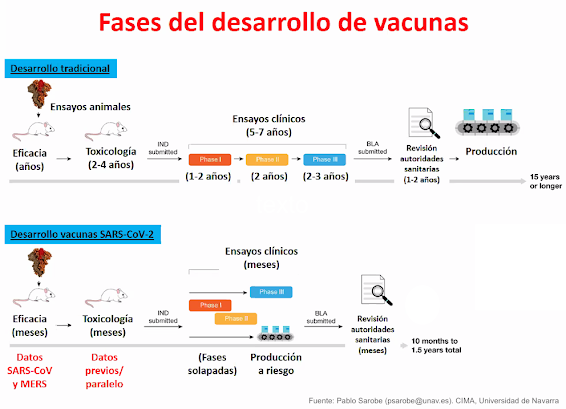
Como hemos comentado, en menos de un año tenemos más de 150 propuesta de vacunas contra la COVID-19, empleando todo tipo de estrategias, desde las más novedosas (ARNm) hasta las más clásicas (virus completos inactivos). En condiciones de emergencia, como es esta pandemia se agilizan los procedimientos para autorizar el uso de nuevas vacunas. Varias son las causas por las que en menos de un año vamos a tener varios candidatos en el mercado, cuando el proceso normal suele durar más de diez años de media: i) no se parte de cero, ya había varios grupos de investigación trabajando en proyectos de vacunas para virus similares (ébola, zika, SARS, MERS, …); ii) algunos de estos proyectos con otros coronavirus ya habían llegado hace años a fase clínica I, y se ha tenido en cuenta esa experiencia previa; iii) se ha invertido una cantidad de dinero como jamás se había hecho en la historia de la ciencia, lo que ha permitido realizar los experimentos con mucha mayor rapidez; iv) está habiendo una colaboración internacional también única en la historia, entre universidades, centros de investigación, empresas farmacéuticas, gobiernos y ONGs; v) las agencias reguladoras lo han priorizado mediante un sistema de evaluación continua, reduciendo la burocracia y los tiempos de espera, pero sin saltarse ninguna etapa; vi) se han podido solapar fases clínicas I y II, de manera que antes de finalizar una se ha comenzado la siguiente; vii) la fase clínica III ha reclutado varios miles de voluntarios de varios países y grupos diferentes, por lo que sus resultados son estadísticamente más significativos que en otros ensayos; viii) la fabricación de las vacunas se está haciendo asumiendo un riesgo: se están fabricando hace meses sin saber si finalmente se van a aprobar, por eso pueden salir al mercado nada más recibida la autorización. Además, una vez que sabemos que las vacunas son seguras y eficaces en las fase clínicas anteriores, no hay que olvidar que después continúa una fase IV de vigilancia, para seguir evaluando su seguridad (posibles efectos secundarios muy poco frecuentes que es imposible detectar con miles de voluntarios pero que se ponen de manifiesto cuando se prueba en millones de personas), y su efectividad (si realmente funciona en el control de la pandemia).
Así como el 2020 ha sido el año del coronavirus, podemos confiar en que el año 2021 sea el año de las vacunas, el año en el que comencemos a controlar por fin esta pandemia. Hay motivo para la esperanza.
Lea el artículo original aquí